Thérapies cellulaires autologues de l'arthrose
Principes du traitement
L'aspirat de moelle osseuse (BMA) contient un mélange complexe de composants cellulaires et de plaquettes (globules blancs, globules rouges, et précurseurs hématopoïétiques et non hématopoïétiques, y compris des cellules souches mésenchymateuses(CSM)).
Quatre caractéristiques définissent les CSM : les capacités à se reproduire, à se différencier en plusieurs types cellulaires dont les chondrocytes, à exercer des fonctions paracrines et des fonctions de signalisation qui influencent l'environnement dans lequel elles sont présentes.
La centrifugation du BMA permet de séparer les différents éléments du plasma et de les concentrer. Il contient une forte concentration de plaquettes. On obtient ainsi un concentré de moelle osseuse (BMC) qui correspond à un LR-PRP (plasma enrichi en plaquettes et en leucocytes)
Les plaquettes sont formées à partir du cytoplasme des mégacaryocytes (MK), qui résident dans la moelle osseuse (MO). Chaque MK mature peut produire environ 3 000 plaquettes. Pour produire des plaquettes, les MK étendent des protubérances cytoplasmiques, appelées proplaquettes, dans les vaisseaux sinusoïdaux de la MO, puis les plaquettes sont libérées dans le courant sanguin des sinusoïdes médullaires de la moelle (modèle d'écoulement).
La durée de vie des plaquettes est en moyenne de 8 à 10 jours.
Le plasma du sang du compartiment vasculaire de la moelle osseuse permet de recueillir un plasma enrichi en plaquettes nouvellement synthétisées, ce qui permet d'avoir une durée de vie de la majorité des plaquettes injectées de 8 à 10 jours. Donc, le plasma du compartiment vasculaire de la moelle osseuse permet d'avoir un relargage in situ plus long et plus important de facteurs de croissances et de cytokines anti-inflammatoires.
Ces plaquettes contiennent un nombre important de facteurs de croissance, de chimiokines et de cytokines qui stimulent la proliferation des CSM endogènes et exogènes, leur différenciation chondrocytaire, induisent une synthèse du collagène et réduisent les taux de cytokines inflammatoires.
Les produits biologiques BMC et PRP sont un mélange complexe de nombreuses molécules bioactives considérées comme importantes pour la régénération des tissus fonctionnels.
Les produits biologiques BMC et LR PRP entraînent une chimiotaxie et une chimiokinèse des CSM plus importantes que celles de LP PRP.
Hannah L. Holmes et al., « Facilitated Recruitment of Mesenchymal Stromal Cells by Bone Marrow Concentrate and Platelet
Rich Plasma », éd. par Jonghoon Choi,PLOS ONE13, no3 (22 mars 2018): e0194567.
Réseau vasculaire intra médullaire
Les 3 étapes du traitement
- 1 : IRM du genou. Cet examen fait l’objet d’une prise en charge classique par la Sécurité Sociale
- 2 : Injection intra articulaire de PRP. Cette partie ne fait pour l’instant pas l’objet d’une prise en
charge par la Sécurité Sociale et reste à la charge du patient (90 € pour le Kit de prélèvement et 40 €
pour AHN (Acte Hors Nomenclature).
- 3 : Une semaine après : Prélèvement de sang du compartiment vasculaire médullaire au niveau de
l’épine iliaque postérieure et Injection intra articulaire. Cette partie ne fait pour l’instant pas l’objet
d’une prise en charge par la Sécurité Sociale et reste à la charge du patient (400 € pour le Kit de
prélèvement et 320 € d'AHN.
Pour pouvoir bénéficier du traitement
Nécéssité d'arrêts des traitements AINS (anti inflammatoires) et Anti Aggrégants Plaquettaires, après accord du Médecin traitant et/ou du Cardiologue .
•Patients sous AINS ou Corticoïdes per Os (48h avant et 3 semaines après)
•Patients sous Anti Aggrégants Plaquettaires (8 semaines avant et 1 semaine après)
•Pas d’infiltration corticoïdes 6 semaines avant et 12 semaines après.
Pour prendre RDV mail to :
contact.bmc@imagerie-enosis.fr
########
Injection intra-articulaire de concentré de moelle osseuse pour le traitement de la gonarthrose
Etude sur 120 cas
Alain Silvestre
Spécialiste d'imagerie de l'appareil locomoteur
Radiologie interventionnelle et médecine régénératrice de l'appareil locomoteur
Membre du conseil scientifique du GRIIP
Centre de l'Arthrose
6 rue Georges Negrevergne 33700 Mérignac
- Introduction
Notre compréhension de l’arthrose primaire a dépassé le paradigme initial « d’usure » isolé du cartilage. La technologie médicale moderne a dévoilé que l’arthrose primaire est une maladie dégénérative multifactorielle, hétérogène et globale de l’articulation influencée par des facteurs génétiques et environnementaux. La pathogenèse de l’arthrose primaire implique des interactions de processus mécaniques, cellulaires et biochimiques au sein de l’articulation, la synoviale, le périoste, l’os sous-jacent et le cartilage, perpétuant finalement un cycle malveillant d’inflammation, de chondrotoxicité et de modification ostéochondrale1.
Si bien que l’arthrose (OA) est définie maintenant comme une affection articulaire chronique inflammatoire de basse intensité, caractérisée par la destruction progressive du cartilage articulaire, entraînant des douleurs et une perte fonctionnelle, l’arthrose du genou étant le type le plus fréquent. Le cartilage articulaire est un tissu conjonctif non vascularisé et non innervé qui peut subir de nombreuses modifications à la suite de microtraumatismes ou de modifications liées à l’âge. En raison du nombre limité de capacités prolifératives, les chondrocytes articulaires ont une faible capacité d’autoréparation. Même des blessures mineures peuvent évoluer vers une dégénérescence articulaire importante.
Récemment, plusieurs options thérapeutiques ont été explorées pour l’arthrose, notamment la chirurgie telle que la microperforation arthroscopique du cartilage ou la greffe de chondrocytes ; cependant, ces derniers sont invasifs et ont montré divers degrés d’efficacité. Les options de traitement conservateur, telles que les anti-inflammatoires non stéroïdiens (AINS) oraux et l’administration intra-articulaire de stéroïdes ou d’acide hyaluronique, n’ont montré aucun effet durable sur l’inflammation.
De nouvelles perspectives curatives ont émergé, notamment la thérapie cellulaire avec l’utilisation de l’injection intra-articulaire de plasma enrichi en plaquettes (PRP) et de concentré de moelle osseuse (CMO). Le CMO a un nombre élevé de plaquettes et des concentrations élevées de facteurs de croissance actifs et de cytokines. Des preuves de niveau 1 ont montré que l’injection intra-articulaire de CMO dans la gonarthrose est un traitement symptomatique potentiel.
2. PRP et CMO
Le PRP est classiquement obtenu par centrifugation du sang prélevé au niveau veineux.
Dernièrement, il a été montré que l’on pouvait obtenir du PRP à partir du sang prélevé au niveau de l’os spongieux dans le compartiment vasculaire de la moelle osseuse par ponction-aspiration (AMO : Aspirat de moelle osseuse). Par simple centrifugation, on obtient un PRP qui sera nommé PRP d’AMO. Ce PRP d’AMO correspond à un CMO (concentré de moelle osseuse) avec réduction du nombre de globules rouges de plus de 95 % par rapport à l’AMO, nous permettant d’obtenir ainsi un LR-PRP (Leucocyte Rich PRP) in fine 2,3.
Les plaquettes sont formées à partir du cytoplasme des mégacaryocytes (MK), qui résident dans la moelle osseuse (MO). Chaque MK mature peut produire environ 3 000 plaquettes 4. Pour produire les plaquettes, les MK étendent des protubérances cytoplasmiques, appelées proplaquettes, dans les vaisseaux sinusoïdaux de la MO, puis les plaquettes sont libérées dans le courant sanguin des sinusoïdes médullaires de la moelle (modèle d’écoulement) 5.
La durée de vie des plaquettes est en moyenne de 8 à 10 jours 6.
Le PRP du sang du compartiment vasculaire de la moelle osseuse permet de recueillir un plasma enrichi en plaquettes nouvellement synthétisées 7, ce qui permet d’avoir une durée de vie de la majorité des plaquettes injectées de 8 à 10 jours contre une décroissance de 1/8 des plaquettes par jour pour le PRP du sang veineux.
Il a été montré que lorsqu’une procédure de séparation par densité est appliquée à un échantillon d’AMO, la préparation finale de CMO a une concentration accrue de plaquettes, de facteurs de croissance et de cytokines, ce qui peut potentiellement avoir des effets anabolique et anti-inflammatoire sur l’articulation du genou arthrosique 8.
Le concentré de moelle osseuse contient divers facteurs de croissance, tels que les facteurs de croissance TGF bêta (favorisent la prolifération et la différenciation des chondrocytes) ; BMP-2 (prolifération des chondrocytes, synthèse de matrice et hypertrophie) ; BMP-7 (favorise la production de matrice extracellulaire) ; VGEF/PDGF (angiogenèse, cicatrisation des tissus), FGF (différenciation chondrogénique), cellules souches plaquettaires et mésenchymateuses9.
Hannah L. Holmes et coll. ont montré que ce type de produit biologique entraîne une chimiotaxie et une chimiokinèse des CSM (cellules stromales mésenchymateuses) plus importantes que celles du LP-PRP (Leucocyte poor PRP)10.
Les molécules bio actives (MBA) du PRP d’AMO, agissent sur les CSM résidentes en stimulant la synthèse des médiateurs prorégénératifs 11 et la production de matrice extracellulaire (MEC) de cartilage hyalin 12.
Ces MBA ont également une puissante action anti-inflammatoire 13.
Ceci est particulièrement vrai pour l’antagoniste du récepteur de l’interleukine-1 (IL-1ra), présent à des concentrations élevées et qui agit comme un puissant agent anti-inflammatoire en inhibant le catabolisme de l’IL-1 14. Cassano et coll. ont en effet montré un taux de IL1ra dans le plasma de CMO plus important que dans le PRP standard, conférant un meilleur effet anti-inflammatoire au plasma de CMO.
Les concentrations d’IL-1ra étaient 20 fois supérieures (p = 0,001 8) dans les échantillons de CMO (13 432 pg/mL) par rapport au PRP (588 pg/mL).
Pour un traitement efficace, un rapport IL-1ra/IL-1 de 10/1 à 100/1 est suffisant pour bloquer l’IL-1.
Le rapport IL-1ra/IL-1β dans les échantillons de CMO variait de 249/1 à 17 568/1, indiquant un effet inhibiteur net sur IL-1.
L’antagoniste du récepteur de l’interleukine-1 (IL-1 ra) a montré une activité modificatrice de la maladie dans des modèles précliniques d’arthrose animale 15,16.
Des études récentes ont montré que les processus inflammatoires jouent un rôle très important dans la pathogenèse de l’arthrose. Les cytokines pro-inflammatoires sont des médiateurs très importants dans l’arthrose et les principales cytokines comprennent le TNF-a, l’IL1 et l’IL6. L’IL1 est considérée comme l’une des cytokines pro-inflammatoires les plus puissantes. Lorsque le tissu est enflammé, IL1 semble jouer un rôle important dans la transmission du signal cellulaire. IL1-RA est un antagoniste naturel de l’IL1 et sa fonction anti-inflammatoire est médiée par plusieurs voies différentes 17.
Le principe thérapeutique repose sur la synergie de ces différentes MBA du PRP d’AMO, considérées comme importantes pour la régénération des tissus fonctionnels 18, 19, 20.
Sur le plan clinique, les 2 dernières méta-analyses de niveau 1 montrent que les injections intra-articulaires de plasma enrichi en plaquettes (PRP) sont plus efficaces dans le traitement de l’arthrose du genou en termes de douleur et d’amélioration fonctionnelle à 6 et 12 mois de suivi, par rapport à d’autres injections, sérum physiologique, acide hyaluronique, ozone et corticostéroïdes 21, 22.
Awad et coll. dans leur méta-analyse ont montré que l’injection de CMO peut considérablement réduire la douleur et améliorer la fonction du genou dans pratiquement toutes les études évaluées 23.
De nombreuses études ont estimé que l’utilisation immédiate et l’injection de CMO fraîchement isolé a ses propres avantages. L’hétérogénéité de la composition du CMO favorisera de manière synergique la régénération du cartilage 23, 24.
La faisabilité et la sécurité des injections de CMO ont été confirmées par l’étude d’Orozco et coll., avec une amélioration rapide et progressive des indices algofonctionnels approchant les 65 % à 78 % à un an.
De plus, la quantification de la qualité du cartilage par T2 mapping avec mesure des temps de relaxation a montré une diminution très significative des zones de cartilage pauvres (en moyenne, 27 %), avec amélioration de la qualité du cartilage chez 11 des 12 patients 25.
Les travaux détaillés ci-dessous, de Peter A. Everts et coll., montrent bien l’Interaction Leucocytes/Plaquettes et l’importance de ces mécanismes pour la modulation de l’inflammation 26.
« L’activation plaquettaire décharge les stockages granulaires plaquettaires, avec la libération de phospholipides à partir des membranes plaquettaires détruites. Ces voies métaboliques transcellulaires impliquent la génération de médiateurs lipidiques dérivés de l’acide arachidonique à partir des phospholipides plaquettaires, capables de moduler l’inflammation. L’effet des plaquettes activées sur les neutrophiles permet à ces derniers d’absorber l’acide arachidonique qui a été libéré par les phospholipides de la membrane plaquettaire. Cette absorption par les neutrophiles est évocatrice, car ils peuvent convertir les lipides d’acide arachidonique dérivés des plaquettes en divers leucotriènes (LT) et autres molécules. Les LT fonctionnent comme des signaux chimiotactiques efficaces pour mobiliser les cellules immunitaires. Cependant, les plaquettes connectées aux neutrophiles qui produisent des LT peuvent rapidement consommer ces médiateurs lipidiques arachidoniques inflammatoires et les convertir en lipoxines (LX). Les lipoxines sont des métabolites de la voie de l’acide arachidonique, comme l’ont décrit Hamberg et Samuelsson, et sont des molécules anti-inflammatoires très puissantes qui jouent un rôle important en limitant l’activation des neutrophiles pro-inflammatoires, en empêchant leur migration dans les tissus et en favorisant la résolution de l’inflammation. Il est important de noter que les plaquettes n’ont pas la capacité de synthétiser des lipoxines sans les LT produits par les neutrophiles. Ce passage de la génération initiale de médiateurs lipidiques pro-inflammatoires à des médiateurs lipidiques finalement anti-inflammatoires dans les neutrophiles est censé empêcher un nouveau recrutement de neutrophiles et une activation inflammatoire tout en activant simultanément des voies de résolution qui peuvent accélérer la guérison des tissus.
Les bioformulations de C-PRP avec une dose importante de plaquettes et de monocytes imiteront l’activité naturelle des cellules Th-2 pour produire de l’IL-4 anti-inflammatoire au site de traitement. Il s’agit d’un résultat important, car l’IL-4 aidera les macrophages à se convertir en MP-2, le phénotype régénérateur, tandis que l’IFN-γ modifie les macrophages en MP-1, le type inflammatoire, en fonction de la dose et du temps. De même, l’activation de l’IL-4 stimule les MP-2 pour différencier les cellules Treg en cellules Th2, produisant potentiellement de l’IL-4 supplémentaire.
Il est intéressant de noter qu’en réponse à des produits biologiques dérivés de tissus, les cellules Th conduisent les phénotypes de macrophages vers des phénotypes prorégénératifs, d’une manière dépendante de l’IL-4. Dans ce contexte, les molécules plaquettaires du PRP peuvent favoriser la polarisation et la différenciation des sous-types de macrophages par la production de divers stades macrophagiques et potentiellement moduler la diaphonie des macrophages avec d’autres cellules immunitaires, par exemple, les voies du facteur nucléaire kappa de la chaîne légère, amplificateur des cellules B activées (NF-kB) dans les cellules synoviales et les chondrocytes. Dans le PRP, la dose élevée de plaquettes et de monocytes représente un potentiel de traitement biologique unique. Ces deux types de cellules concentrées libèrent une abondance de protéines et de molécules pour stimuler les interactions complexes entre les cellules et les mécanismes immunomodulateurs liés à l’arthrose et aux tendinopathies. Malheureusement, on ne pense généralement pas aux fonctions de résolution de l’inflammation des leucocytes dans le LR-PRP injecté, ni aux fonctions d’interaction leucocytes-plaquettes, ni aux effets sur les tissus locaux. De plus, les populations de leucocytes présentes localement qui ont été recrutées chimiquement de la circulation vers les tissus traités en réponse à un traitement par PRP sont également toutes activées. Il semble y avoir une différence claire entre les leucocytes amorcés par les plaquettes et les leucocytes non activés. Il est important de noter que les leucocytes non activés, lorsqu’ils sont associés aux plaquettes, libèrent des médiateurs qui empêchent le recrutement ultérieur de cellules activées et peuvent supprimer l’inflammation26.
Le rôle important des monocytes/macrophages a été bien mis en évidence dans l’étude de Wang et coll. et Muthu et coll.
Dans son étude, Wang montre que les monocytes de la moelle osseuse sont une riche source de progéniteurs de macrophages, et que le nombre de macrophages M2 ainsi que la concentration d’IL-10 dans la synovie sont augmentés après l’injection de BMC autologues dans les articulations arthrosiques équines. Histologiquement, les articulations traitées par BMC étaient comparables à des articulations saines 27.
Muthu montre, lui, qu’une association positive statistiquement significative a été notée entre les (CFU) développées à partir du CMO et leur nombre de cellules mononucléaires (MNC) (r = 0,95, p < 0,001) (fig.1). Par conséquent, le nombre de MNC pourrait être utilisé comme marqueur de substitution de la capacité des cellules mésenchymateuse stromale (MSC) à former efficacement des colony-forming unit 28.
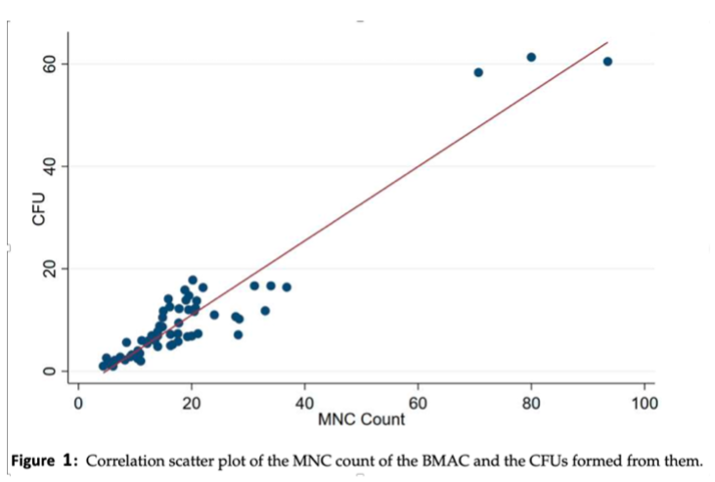
L’ensemble des données ci-dessus suggère un haut potentiel du CMO a traité l’inflammation chronique de l’arthrose et par ce biais à diminuer les douleurs et la dégradation du cartilage.
Compte tenu de ce potentiel thérapeutique du CMO sur la maladie arthrosique, nous avons mené une étude dans le service pour évaluer l’efficacité de ce traitement sur la gonarthrose, avec des résultats très prometteurs sur le plan algofonctionnel, mais aussi sur la restructuration du cartilage.
3. Résultats de l’étude menée dans le service sur 120 patients atteints de gonarthrose symptomatique traités par injection intra-articulaire de PRP et CMO
3.1 Résumé de l’étude :
• Objectif
Évaluer l’efficacité de l’injection intra-articulaire (IA) de PRP suivi à une semaine d’une IA de concentré de moelle osseuse (CMO) sous guidage radiographique dans le traitement de la gonarthrose (OA), avec un suivi clinique et volumétrique par imagerie par résonance magnétique (RM).
• Méthodes
Cette étude rétrospective a inclus 120 patients consécutifs référés pour une injection intra-articulaire guidée par radiographie de PRP suivi à une semaine d’une injection de BMC pour une gonarthrose symptomatique pour laquelle le traitement conservateur avait échoué. Un groupe témoin de 33 patients atteints de gonarthrose symptomatique a été inclus à des fins de comparaison. Les données sur l’International Knee Documentation Committee (IKDC), l’échelle visuelle analogique (EVA) et les scores de l’indice d’arthrose des universités Western Ontario et McMaster (WOMAC) ainsi que l’imagerie IRM volumétrique (utilisant la séquence de cartographie T2) ont été recueillies avant et 12 mois après l’injection, et les résultats ont été comparés.
• Résultats
Aucun événement indésirable technique n’a été noté lors de l’aspiration de la moelle osseuse, de la préparation du CMO ou de l’injection intra-articulaire de CMO. Aucun événement indésirable clinique n’a été signalé au cours du suivi à long terme. Tous les scores moyens se sont améliorés entre le départ et 12 mois après le traitement (EVA 5,5 à 3,5, P < 0,0001 ; WOMAC 36 à 23, P < 0,0001 ; et IKDC 44 à 57, P < 0,0001). L’imagerie par résonance magnétique à 1 an de suivi après le traitement a montré une augmentation moyenne de 4,6 % du volume de cartilage hyalin normal par rapport à celui de référence, suggérant une stabilisation du processus de dégradation du cartilage. En revanche, le groupe de patients non traités a montré une diminution moyenne de 2,6 % du volume de cartilage normal.
• Conclusions
Les résultats suggèrent que l’injection intra-articulaire de PRP suivi d’une IA de CMO à une semaine pourrait être une option prometteuse pour le traitement de la gonarthrose symptomatique et pourrait favoriser la préservation d’un volume de cartilage résiduel sain.
Abréviations
AMO = aspiration de moelle osseuse, CMO = concentré de moelle osseuse, IKDC = International Knee Documentation Committee, MR = résonance magnétique, MSC = cellule souche mésenchymateuse, AINS = anti-inflammatoire non stéroïdien, OA = arthrose, PRP = plasma riche en plaquettes, US = échographie, EVA = échelle visuelle analogique, WOMAC = Western Ontario and McMaster Universities Osteoarthritis Index, injection intra-articulaire = IA
Points forts de la recherche
• Prélèvements de moelle osseuse au niveau de l’épine iliaque postérieure sous guidage échographique, avec analyse des cellules sanguines, ont permis une préparation aisée et une injection intra-articulaire de concentré de moelle osseuse en pratique clinique.
• L’échelle visuelle analogique (EVA) analysée rétrospectivement, l’indice d’arthrose des universités Western Ontario et McMaster (WOMAC) et les scores de l’International Knee Documentation Committee (IKDC) se sont tous améliorés après 12 mois de suivi.
• L’injection intra-articulaire de concentré de moelle osseuse pourrait être une option sûre et prometteuse pour le traitement de la gonarthrose, avec une amélioration fonctionnelle significative et la préservation du volume de cartilage résiduel sain détecté sur les images de résonance magnétique.
3.2. Caractéristiques de l’étude
- Étude monocentrique, rétrospective
- 120 patients (54 F — 66 H)
- Moyenne d’âge : 54 ans (20 – 84 ans)
- IMC 25
- Gonalgies avec lésions chondrales à l’IRM Stade 2 à 4
- IA PRP à J0 et IA CMO à J7
- Suivi J0 — 1 an : WOMAC, IKDC, EVA, IRM
3.3. Matériels et méthodes
3.3.1. Inclusion des patients et clinique
Les dossiers cliniques et radiologiques de 227 patients ont été revus rétrospectivement. Ils ont été adressés entre février 2018 et mars 2020 au service de radiologie interventionnelle par les services de médecine du sport et d’orthopédie pour l’injection intra-articulaire de PRP/CMO après échec d’un traitement conservateur par AINS oraux initiaux et kinésithérapie.
Les critères d’inclusion étaient une gonarthrose évoluant depuis plus de 6 mois, avec des lésions de chondropathie superficielles ou profondes à l’IRM, et un âge compris entre 20 et 84 ans.
Les critères d’exclusion étaient une fracture antérieure du genou, un traitement intra-articulaire antérieur (p. ex., injection de corticostéroïdes, injection d’acide hyaluronique, injection de plasma riche en plaquettes [PRP], autre thérapie cellulaire), ou un traitement chirurgical. Les patients ayant reçu un traitement intra-articulaire supplémentaire ou un traitement chirurgical au cours du suivi ont également été exclus. 120 patients ont été finalement inclus.
De plus, un groupe témoin de 33 patients a été identifié, caractérisé par une gonarthrose symptomatique (diagnostiquée par IRM), qui ont subi une IRM de suivi de leur lésion cartilagineuse 1 an après la première IRM et qui n’ont pas subi d’injections au genou ou de traitement chirurgical au cours de l’année précédente sur la base des mêmes critères d’inclusion et d’exclusion.
Selon la classification de l’Organisation mondiale de la santé, l’utilisation de stéroïdes oraux et d’AINS ainsi que les traitements antalgiques de niveau 1, 2 et 3 ont été évalués au cours du suivi. L’évaluation des données cliniques à l’inclusion avant le traitement a été réalisée à l’aide de l’International Knee Documentation Committee (IKDC), de l’échelle visuelle analogique (EVA, 0–10) et de l’indice d’arthrose des universités Western Ontario et McMaster (WOMAC).
3.3.2. Évaluation avant le traitement. Données d’imagerie par résonance magnétique avant le traitement
Tous les patients ont subi une évaluation par IRM au départ. Les patients ont été imagés en décubitus dorsal avec extension complète du membre. Tous les examens d’imagerie IRM ont été réalisés à 1,5 Tesla entre 15 h et 17 h à température ambiante contrôlée (18◦C) pour pallier les variations diurnes et liées à la température du cartilage (13,14). La cartographie a été réalisée dans le même plan pour chaque patient, dans un plan sagittal strict. Les séquences de cartographie T2 ont été évaluées sur un poste de travail (GE Medical Systems, Waukesha, Wisconsin) à l’aide d’un logiciel semi-automatisé dédié à la cartographie T2. Tous les examens d’IRM ont été anonymisés.
La cartographie T2 permet de caractériser l’organisation structurale et le contenu matriciel du cartilage. Une telle approche quantitative peut être réalisée dans la pratique clinique, qui peut être utilisée comme biomarqueur précoce de l’arthrose du genou. Les mesures du temps de relaxation T2 reflètent ces changements physiopathologiques. La technique de cartographie T2 a récemment montré son potentiel dans l’évaluation de la qualité de la composition du cartilage, car le temps de relaxation transverse (T2) reflète la capacité des molécules de protons à se déplacer et à échanger de l’énergie à l’intérieur de la matrice cartilagineuse. Chaque variation du contenu de la matrice ou de l’organisation du réseau de collagène modifie le T2. Conformément à la littérature, compte tenu des paramètres cliniques, le seuil de la valeur normale de T2 a été fixé à 40 millisecondes (15,16). Cette limite a été maintenue volontairement basse pour être sûr d’exclure le fibrocartilage des mesures, quelle que soit la profondeur du cartilage. Le cartilage était considéré comme sain lorsque les valeurs de T2 variaient de 0 à 39 millisecondes (17,18). Enfin, 2 opérateurs (B.D. et A.S.) spécialisés en radiologie musculosquelettique avec 8 et 25 ans d’expérience ont analysé consensuellement les résultats de l’examen IRM. Les mesures volumétriques du cartilage sain ont été enregistrées ; pour cette étude, l’épaisseur du cartilage n’a pas été évaluée.
3.3.3. Protocole d’injection
Le traitement consistait en une injection de 10 ml de PRP IA suivie à 1 semaine par une injection de CMO IA (17 ml en moyenne).
Préparation du PRP : pour la préparation du PRP, le kit Hy-Tissue PRP® 50 (Fidia Farmacéutica) a été utilisé. En bref, 45 ml de sang périphérique ont été prélevés et anticoagulés avec 5 ml de citrate de sodium à 3,8 %. Les 50 ml de sang citraté ont été centrifugés à 1800 tr/min pendant 8 minutes à l’aide de Duografter® II (Fidia Farmacéutica, Espagne) et 10 ml de PRP pur ont été obtenus selon les instructions du fabricant. Pour le contrôle qualité, 0,5 ml de PRP a été utilisé pour l’analyse des plaquettes (PLT), des globules rouges (RBC) et des leucocytes (WBC) à l’aide d’un analyseur d’hématologie automatisé (Stel3 — Linear Chemical, Espagne).
L’injection intra-articulaire de PRP a été réalisée immédiatement après l’obtention à l’aide d’une aiguille de calibre 21. La position de l’aiguille intra-articulaire a été confirmée en temps réel avec arthrographie et absence de résistance lors de l’injection. Après la procédure, le patient a été surveillé pendant 2 heures pour enregistrer tout événement indésirable.
La même procédure a été répétée 1 semaine plus tard pour l’IA de CMO.
L’AMO a été obtenu après que les patients ont reçu à la fois du protoxyde d’azote inhalé (MEOPA ; Air Products, Paris, France) et une anesthésie locorégionale avec 1 % de lidocaïne (xylocaïne ; Pierre Fabre Médicament Production, Boulogne Billancourt, France). Pour le protoxyde d’azote inhalé, le débit a été déterminé sur la base de la ventilation spontanée des patients à travers un masque oronasal. Une anesthésie locorégionale à l’aide d’une aiguille intramusculaire de calibre 21 a été administrée en utilisant 10 mL de lidocaïne à 1 % à côté de la partie latérale de la face postérosupérieure de l’os iliaque.
Les échantillons BMA ont été obtenus à l’aide d’une canule de récolte (Bone Marrow Harvest Needles, Argon Medical Devices, Plano, Texas) sous contrôle échographique (sonde linéaire 17 MHz, mode B, EPIC 7 ; Philips Healthcare, Amsterdam, Pays-Bas). L’aiguille de récolte était de calibre 13, de 10,2 cm de long, avec une pointe pointue en « diamant », des trous latéraux et un stylet à pointe pyramidale. La face postérieure de l’épine iliaque était ponctionnée à une angulation de 45◦ vers la ligne médiane pour éviter la ponction de l’articulation sacro-iliaque. Quarante millilitres d’AMO ont été aspirés à l’aide d’une seringue à pression sous vide de 30 ml contenant 2 ml de solution anticoagulante de citrate dextrose A (80 %) et d’héparine (5 000 UI/mL ; 20 %) pour chaque 20 ml d’AMO. L’AMO a été traité à l’aide du kit Hy-Tissue PRP® 50 (Fidia Farmacéutica) en utilisant un cycle de centrifugation de 5 minutes à 1500 RPM. Après aspiration de la partie cellulaire, en évitant la collecte d’érythrocytes, un volume final de 11 à 20 ml de CMO a été obtenu (moyenne 17 ml). Pour le contrôle de la qualité, une aliquote de 1 ml de CMO a été utilisée pour l’analyse. Le contenu des leucocytes, des cellules mononucléaires (MNC), des granulocytes, des globules rouges et des plaquettes de chaque AMO et CMO a été déterminé à l’aide d’un analyseur d’hématologie automatisé (Stel3, Barcelone, Espagne).
L’injection intra-articulaire de CMO sous contrôle arthrographique avec injection de 2 ml de produit de contraste iodé a été réalisée. Une aiguille intramusculaire de calibre 21 a été insérée sur le côté médial de la poche suprapatellaire, après quoi une injection de CMO a été réalisée. La position de l’aiguille intra-articulaire a été confirmée par l’arthrogramme. Les patients ont été surveillés pendant 2 heures pour détecter la survenue d’hématomes, d’infections et de douleurs à l’aide de l’EVA. Après l’injection, les patients ont été autorisés à marcher sans aide et ont été invités à éviter tout effort physique pendant 1 mois (19).
3.3.4. Suivi clinique et IRM
L’utilisation de stéroïdes oraux et d’AINS ainsi que les traitements antalgiques de niveau 1, 2 et 3 ont été évalués au cours du suivi. Les événements indésirables significatifs ont été définis comme l’apparition de douleurs avec un score supérieur à 3 à l’EVA pendant les 7 jours après l’intervention, hématome symptomatique au site de ponction (douloureux, compressif ou avec limitation des mouvements osseux du bassin) pendant les 2 premières semaines, infection du genou ou autour du site de ponction dans les 3 mois suivant l’intervention et fracture de l’os iliaque après prélèvement. Les patients ont été invités à contacter le médecin s’ils avaient besoin d’AINS ou de stéroïdes après la procédure. Pour cela, les patients disposaient d’un numéro de téléphone direct pour signaler des problèmes ou un traitement antalgique après l’intervention. Tout événement indésirable ou traitement antalgique signalé était alors noté dans le dossier du patient.
De plus, les patients ont été examinés 12 mois après l’injection pour l’efficacité du traitement. Les tests IKDC, VAS et WOMAC ont été utilisés pour évaluer les résultats cliniques. Les examens d’imagerie IRM (utilisant le même protocole d’imagerie IRM dans les mêmes conditions) ont permis la mesure du volume de cartilage sain (fig. 3). Le groupe témoin de patients sans traitement BMC intra-articulaire a subi exactement les mêmes suivis cliniques et d’imagerie IRM de routine.
3.3.5. Analyse d’images et méthodes statistiques
Les données d’imagerie IRM acquises avant et après la procédure ont été centralisées sur un poste de travail dédié (station de travail Advantage ; GE Healthcare) à l’aide d’un logiciel dédié à la cartographie T2. Celles-ci ont été analysées de manière consensuelle par les mêmes radiologues (A.S. et B.D.), en aveugle aux données cliniques. Toutes les données ont été enregistrées sur des formulaires de rapport de cas. Les analyses statistiques ont été effectuées à l’aide du logiciel SAS (SAS Institute, Cary, Caroline du Nord). L’évaluation des scores IKDC, VAS et WOMAC et une comparaison des volumes de cartilage d’imagerie IRM ont été réalisées.
Les variables catégorielles ont été décrites sous forme de pourcentages, tandis que les variables continues ont été décrites sous forme de moyennes, d’écarts types et d’intervalles de confiance à 95 % de la moyenne. Des tests paramétriques (test t apparié) ont été utilisés pour les distributions normales, et le test de Wilcoxon a été utilisé pour les distributions non paramétriques. La symétrie des données a été analysée à l’aide de la méthode D’Agostino et Pearson.
Pour tous les tests, P < 0,05 était considéré comme significatif. Toutes les analyses statistiques ont été effectuées à l’aide de GraphPad Prism, version 7.00, pour Windows (GraphPad Software, La Jolla, Californie).
3.4. Résultats
3.4.1. Comptage cellulaire du PRP et du CMO
La composition du PRP et du CMO a été évaluée pour chaque patient.
• PRP
- Quantité injectée : 10 ml
- Numération du PRP
- Moyenne
- Plq : 512 x 10³/mm³
- GB : 0,4 x 10³/mm³
- GR : 0,02 x 106/mm³
• PRP de Moelle osseuse
- Prélèvement de 40 ml d’AMO
- Centrifugation 1500 rpm 5 min
- Final LR-PRP
- Dosage WBC/RBC/Plt
- Injection intra-articulaire radio guidée
- Quantité moyenne : 17 ml
- Numération LR-PRP
- Moyenne
- Plq : 450 x 10³/mm³
- GB : 29 x 10³/mm³
- GR : 0,5 x 106/mm³
3.4.2. Suivi clinique et IRM
Aucun événement indésirable n’a été noté pendant les procédures d’aspiration d’AMO et d’injection de CMO ou pendant le suivi. De plus, aucun médicament stéroïdien oral, AINS ou traitement analgésique de niveau 1, 2 ou 3 n’a été utilisé.
Les patients ont obtenu une amélioration clinique significative au mois 12, déterminée sur la base d’une comparaison de tous les scores fonctionnels (P < 0,01) :
• scores WOMAC (36,2 ± 18,5 au mois 0 et 22,8 ± 18,5 au mois 12) (fig. 2),
• scores IKDC (44,0 ± 13,7 au mois 0 et 57,0 ± 16,7 au mois 12) (fig. 3),
• scores EVA (5,5 ± 1,8 au mois 0 et 3,5 ± 2,3 au mois 12) (fig. 4).

Figure 2

Figure 3
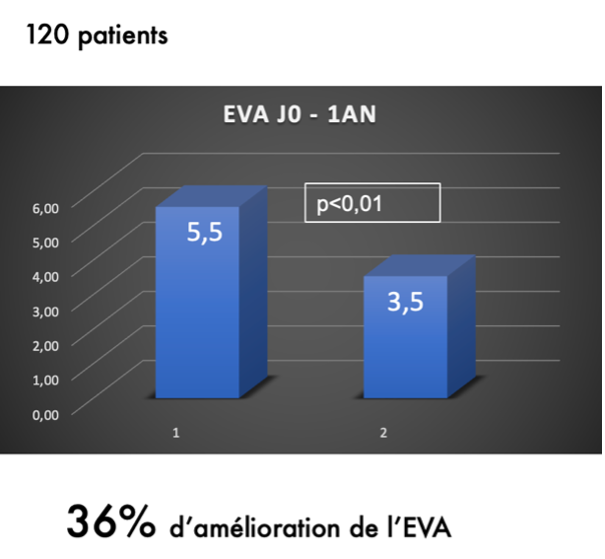
Figure 4
En ce qui concerne le cartilage sain, les résultats ont montré une tendance à la stabilisation du volume du cartilage hyalin, sans changement significatif du volume (P = 0,690) par rapport à celui de référence. L’imagerie par résonance magnétique à 1 an de suivi après le traitement a montré une augmentation moyenne de 4,6 % du volume de cartilage hyalin normal par rapport à celui de référence, suggérant une stabilisation du processus de dégradation du cartilage. En revanche, le groupe de patients non traités a montré une diminution moyenne de 2,6 % du volume de cartilage normal, suggérant que l’injection de PRP/CMO a permis une tendance à la stabilisation du volume de cartilage sain entre le départ et 12 mois après le traitement, contrairement au groupe de patients non traités, dans lequel une diminution significative a été observée (fig. 5 et 5 bis).
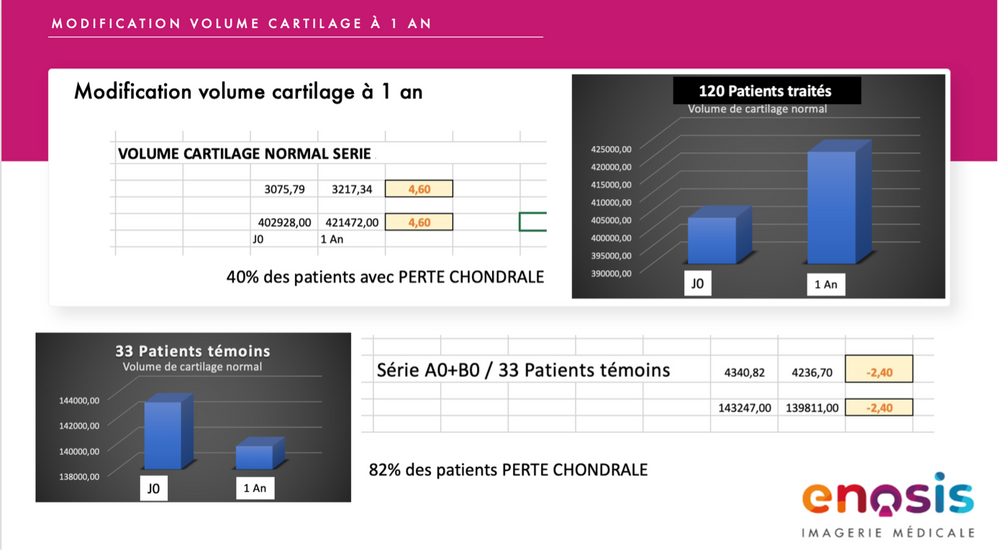
Figure 5
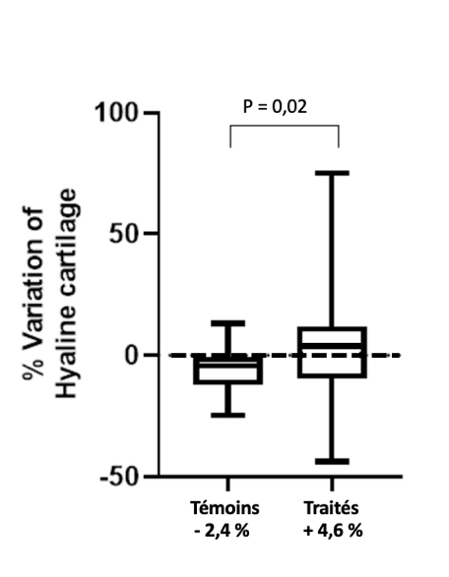
Figure 5 bis
3.4.3. Résultats résumés
2/3 des patients ont eu une amélioration clinique significative à un an.
40 % des patients ont eu une amélioration de plus de 50 % du score Womac à un an.
3.4.4. Résultats par sous-groupes
• Amélioration en fonction de l’âge (fig. 6)
67 % des patients avec une amélioration significative du score de Womac pour un âge inférieur à 60 ans, contre 42 % des patients avec une amélioration significative du score de Womac pour un âge supérieur à 60 ans.
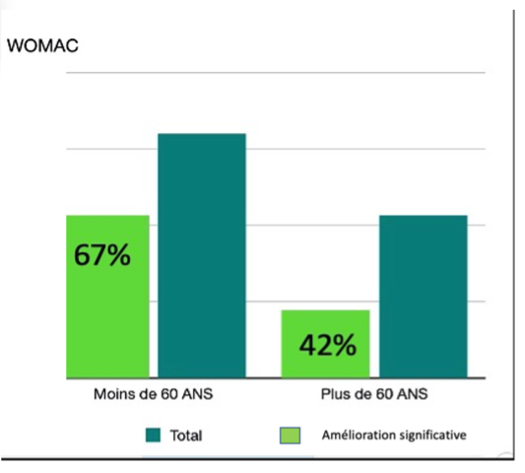
Figure 6
• Amélioration en fonction du stade de Kellgren et Laurence (fig. 7)
68 % des patients avec une amélioration significative du score de Womac pour un stade 2 de Kellgren et Laurence, contre 50 % des patients avec une amélioration significative du score de Womac pour un stade 3 ou 4 de Kellgren et Laurence.
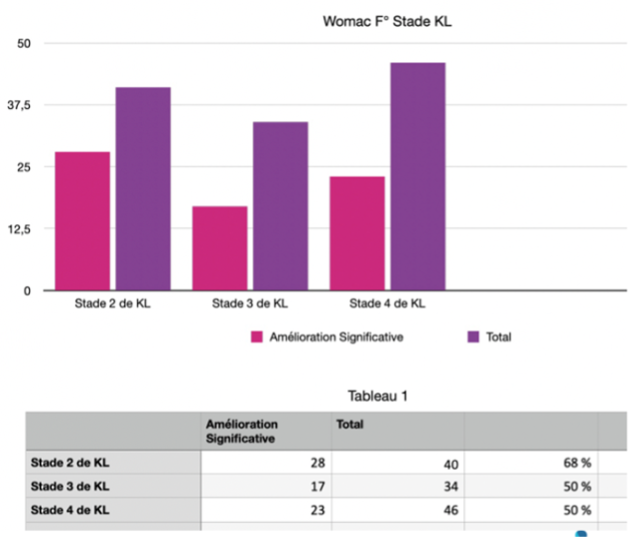
Figure 7
• Amélioration en fonction du score de Worms29 (fig. 8)
72 % des patients avec une amélioration significative du score de Womac pour un score de Worms inférieur à 30, contre 48 % des patients avec une amélioration significative du score de Womac pour un score de Worms supérieur à 30.
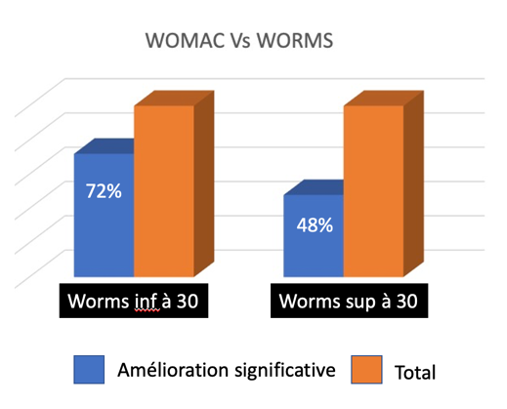
Figure 8
3.5. Conclusion
Les résultats suggèrent que l’injection intra-articulaire de PRP suivi d’une IA de CMO à une semaine pourrait être une option prometteuse pour le traitement de la gonarthrose symptomatique et pourrait favoriser la préservation d’un volume de cartilage résiduel sain.
Les résultats sont d’autant meilleurs que les patients sont jeunes (moins de 60 ans) avec des lésions d’arthrose moins importante (Stade 2 de Kellgren et Laurence).
Case Report :
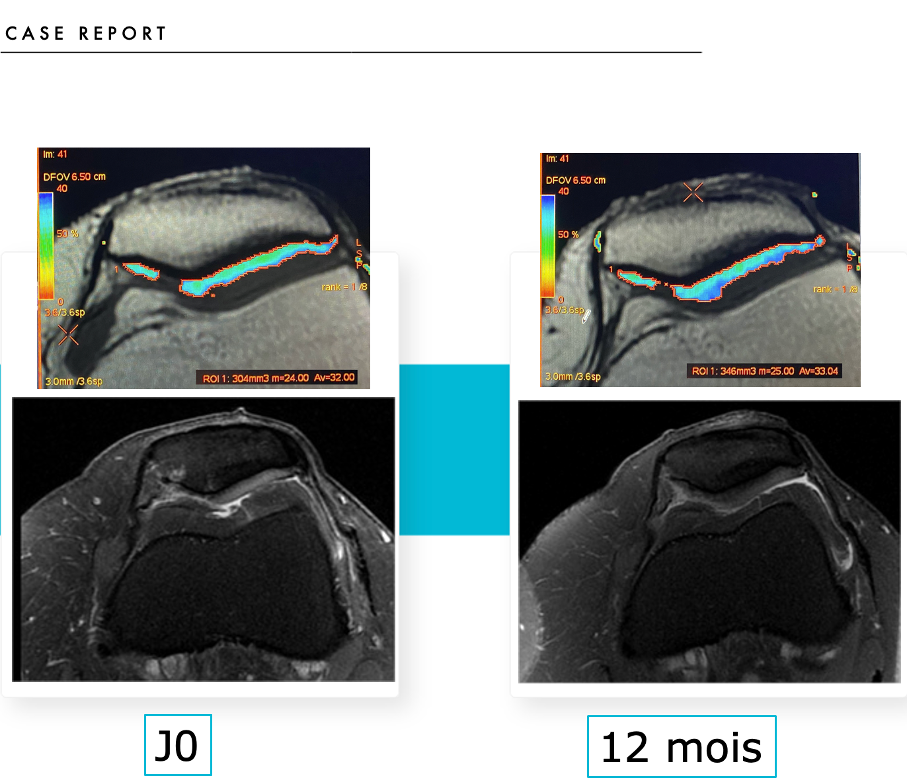
Femme 50 ans, Chondropathie (stade 4) rotulienne isolée.
À un an : score de Womac = 0 (contre 25 avant traitement) et gain de cartilage normal de +35 % : disparition de l’œdème sous-chondral de la facette interne de la rotule et restructuration du cartilage à ce niveau.
Bibliographie
1. Householder, N. A., Raghuram, A., Agyare, K., Thipaphay, S. & Zumwalt, M. A Review of Recent Innovations in Cartilage Regeneration Strategies for the Treatment of Primary Osteoarthritis of the Knee: Intra-articular Injections. Orthop. J. Sports Med. 11, 232596712311559 (2023).
2. Nagata, M. J. H. et al. Platelet-Rich Plasma Derived From Bone Marrow Aspirate Promotes New Cementum Formation. J. Periodontol. 85, 1702–1711 (2014).
3. Von Hoff, D. D., Kuhn, J. G., Burris, H. A. & Miller, L. J. Does intraosseous equal intravenous? A pharmacokinetic study. Am. J. Emerg. Med. 26, 31–38 (2008).
4. Harker, L. A. & Finch, C. A. Thrombokinetics in man. J. Clin. Invest. 48, 963–974 (1969).
5. Becker, R. P. & De Bruyn, P. P. H. The transmural passage of blood cells into myeloid sinusoids and the entry of platelets into the sinusoidal circulation; a scanning electron microscopic investigation. Am. J. Anat. 145, 183–205 (1976).
6. Deutsch, V. R. & Tomer, A. Megakaryocyte development and platelet production. Br. J. Haematol. 134, 453–466 (2006).
7. Junt, T. et al. Dynamic Visualization of Thrombopoiesis Within Bone Marrow. Science 317, 1767–1770 (2007).
8. Piuzzi, N. et al. Bone Marrow Cellular Therapies: Novel Therapy for Knee Osteoarthritis. J. Knee Surg. (2017) doi:10.1055/s-0037-1608844.
9. Xu, L. et al. Tissue source determines the differentiation potentials of mesenchymal stem cells: a comparative study of human mesenchymal stem cells from bone marrow and adipose tissue. Stem Cell Res. Ther. 8, (2017).
10. Holmes, H. L. et al. Facilitated recruitment of mesenchymal stromal cells by bone marrow concentrate and platelet rich plasma. PloS One 13, e0194567 (2018).
11. Wang, Y., Chen, X., Cao, W. & Shi, Y. Plasticity of mesenchymal stem cells in immunomodulation: pathological and therapeutic implications. Nat. Immunol. 15, 1009–1016 (2014).
12. de Girolamo, L. et al. Autologous Matrix-Induced Chondrogenesis (AMIC) and AMIC Enhanced by Autologous Concentrated Bone Marrow Aspirate (BMAC) Allow for Stable Clinical and Functional Improvements at up to 9 Years Follow-Up: Results from a Randomized Controlled Study. J. Clin. Med. 8, 392 (2019).
13. Anitua, E., Sánchez, M. & Orive, G. Potential of endogenous regenerative technology for in situ regenerative medicine☆. Adv. Drug Deliv. Rev. 62, 741–752 (2010).
14. Cassano, J. M. et al. Bone marrow concentrate and platelet-rich plasma differ in cell distribution and interleukin 1 receptor antagonist protein concentration. Knee Surg. Sports Traumatol. Arthrosc. (2016) doi:10.1007/s00167-016-3981-9.
15. Allen, K. D. et al. Gait and behavior in an IL1β-mediated model of rat knee arthritis and effects of an IL1 antagonist: GAIT AND BEHAVIOR IN AN IL1β-MEDIATED ARTHRITIS MODEL AND EFFECTS OF IL1 ANTAGONISM. J. Orthop. Res. 29, 694–703 (2011).
16. Caron, J. P. et al. Chondroprotective effect of intraarticular injections of interleukin-1 receptor antagonist in experimental osteoarthritis. Suppression of collagenase-1 expression. Arthritis Rheum. 39, 1535–1544 (1996).
17. Xu, B. et al. Meta-analysis of the association of IL1-RN variable number of tandem repeats polymorphism with osteoarthritis risk. Acta Orthop. Traumatol. Turc. 53, 497–501 (2019).
18. Schäfer, R. et al. Quantitation of progenitor cell populations and growth factors after bone marrow aspirate concentration. J. Transl. Med. 17, (2019).
19. Ziegler, C. G. et al. Characterization of Growth Factors, Cytokines, and Chemokines in Bone Marrow Concentrate and Platelet-Rich Plasma: A Prospective Analysis. Am. J. Sports Med. 036354651983200 (2019) doi:10.1177/0363546519832003.
20. Cotter, E. J., Wang, K. C., Yanke, A. B. & Chubinskaya, S. Bone Marrow Aspirate Concentrate for Cartilage Defects of the Knee: From Bench to Bedside Evidence. CARTILAGE 194760351774116 (2017) doi:10.1177/1947603517741169.
21. Dai, W.-L., Zhou, A.-G., Zhang, H. & Zhang, J. Efficacy of Platelet-Rich Plasma in the Treatment of Knee Osteoarthritis: A Meta-analysis of Randomized Controlled Trials. Arthrosc. J. Arthrosc. Relat. Surg. 33, 659-670.e1 (2017).
22. Shen, L., Yuan, T., Chen, S., Xie, X. & Zhang, C. The temporal effect of platelet-rich plasma on pain and physical function in the treatment of knee osteoarthritis: systematic review and meta-analysis of randomized controlled trials. J. Orthop. Surg. 12, (2017).
23. Awad, M. E. et al. Meta-Analysis and Evidence Base for the Efficacy of Autologous Bone Marrow Mesenchymal Stem Cells in Knee Cartilage Repair: Methodological Guidelines and Quality Assessment. Stem Cells Int. 2019, 1–15 (2019).
24. Silvestre, A. et al. Intra-articular Injection of Bone Marrow Concentrate for Treatment of Patellofemoral Osteoarthritis: Preliminary Results Utilizing an Ultrasound-Guided Marrow Harvesting Technique. J. Vasc. Interv. Radiol. 34, 71-78.e1 (2023).
25. Orozco, L. et al. Treatment of knee osteoarthritis with autologous mesenchymal stem cells: two-year follow-up results. Transplantation 97, e66-68 (2014).
26. Everts, P. A., Mazzola, T., Mautner, K., Randelli, P. S. & Podesta, L. Modifying Orthobiological PRP Therapies Are Imperative for the Advancement of Treatment Outcomes in Musculoskeletal Pathologies. Biomedicines 10, 2933 (2022).
27. Wang, W. et al. Targeting macrophage polarization as a promising therapeutic strategy for the treatment of osteoarthritis. Int. Immunopharmacol. 116, 109790 (2023).
28. Muthu, S. et al. Factors Influencing the Yield of Progenitor Cells in Bone Marrow Aspiration Concentrate—A Retrospective Analysis of 58 Patients. Biomedicines 11, 738 (2023).
29. Peterfy, C. G. et al. Whole-Organ Magnetic Resonance Imaging Score (WORMS) of the knee in osteoarthritis. Osteoarthr. Cartil. OARS Osteoarthr. Res. Soc. 12, 177–190 (2004).




